Amadeo Avogadro y la Luna
Entre mis contactos del Messenger tengo un amigo que es de lo más impredecible. Nos conocimos durante mis años de carrera debo admitir que desde el principio me sorprendió su originalidad y buen hacer (sobre todo con la chicas… jejejej!!). Javinete, que así se llama el interfecto, es capaz de “sacarle punta” a casi cualquier tema y con su labia no es sorprendente que siempre ande pululando alrededor de mozas de buen ver pero el colmo de los colmos es su destreza en el Messenger!! Cada 2*3 cambia de nick dejando perlitas que mejor ni comentar!!
Bueno, todo esto viene a cuento de su última frasecita… Una que tocaba de pleno mi querida química y en especial un concepto algo complicado de entender, los Moles, pero vayamos por partes, lo primero el curioso Nick: “Todo el volumen de la Luna dividido en bolas de 1mm de radio daría el número de Avogadro”…
 Nada más leerlo seguro que os llama la atención el Número de Avogadro (a partir de ahora NA que soy muuu vago….). Pues bien, este número es una de las constantes más impresionantes que existen dentro de las ciencias, es de una magnitud casi inimaginable, más del doble que la velocidad de la luz, y tan difícil de explicar que sirvió para definir un concepto al que no se le puso nombre definitivo hasta el 1971 aunque el químico italiano Amadeo Avogadro ya intuyó su significado allá por el 1811. La famosa ley que él mismo promulgó, La Ley de Avogadro, dice: "Volúmenes iguales de gases diferentes contienen el mismo número de partículas, a la misma presión y temperatura".
Nada más leerlo seguro que os llama la atención el Número de Avogadro (a partir de ahora NA que soy muuu vago….). Pues bien, este número es una de las constantes más impresionantes que existen dentro de las ciencias, es de una magnitud casi inimaginable, más del doble que la velocidad de la luz, y tan difícil de explicar que sirvió para definir un concepto al que no se le puso nombre definitivo hasta el 1971 aunque el químico italiano Amadeo Avogadro ya intuyó su significado allá por el 1811. La famosa ley que él mismo promulgó, La Ley de Avogadro, dice: "Volúmenes iguales de gases diferentes contienen el mismo número de partículas, a la misma presión y temperatura".
Esta teoría relacionaba pesos con volúmenes. Se puede entender que un número igual de dos compuestos, ya sean elementos gaseosos (He, Helio que es gaseoso), moléculas (como H2, Hidrógeno gaseoso) o compuestos (como el CO2, dióxido de carbono) en las mismas condiciones de temperatura y presión ocupen el mismo espacio, o sea, el mismo volumen, gracias a que el tamaño real de las partículas es ínfimo si lo comparamos frente a los huecos que las separan. Esto se vio demostrado poco después gracias a reacciones (dos volúmenes de H2 y uno de O2 generan dos volúmenes de H2O) y sirvió como base para crear el concepto de concentración tal y como lo conocemos hoy en día, una cantidad de materia dentro de un espacio.
 Pero para relacionar el número real de partículas que hay en un volumen determinado se decidió arbitrariamente usar la masa como referente, me explico: Una molécula de Hidrógeno (H2) pesa 2 “unidades de masa atómica” (Umas) y una de Oxígeno (O2) pesa 32 umas mientras que una de H2O pesa 17 umas, así se comprobó que 4 gramos de H2 reaccionaban exactamente con 32 gramos de O2 para generar 36 gramos de agua (H2O). Esto hizo decidirse a los científicos a crear un nuevo concepto llamado “Mol” que se puede definir como la cantidad de átomos que pesan lo mismo que la masa atómica del compuesto. La definición oficial utiliza al átomo de carbono como referencia ya que éste pesa exactamente 12 umas y la IUPA definió (en 1971) mol como “la cantidad de átomos de carbono que pesan 12 gramos”.
Pero para relacionar el número real de partículas que hay en un volumen determinado se decidió arbitrariamente usar la masa como referente, me explico: Una molécula de Hidrógeno (H2) pesa 2 “unidades de masa atómica” (Umas) y una de Oxígeno (O2) pesa 32 umas mientras que una de H2O pesa 17 umas, así se comprobó que 4 gramos de H2 reaccionaban exactamente con 32 gramos de O2 para generar 36 gramos de agua (H2O). Esto hizo decidirse a los científicos a crear un nuevo concepto llamado “Mol” que se puede definir como la cantidad de átomos que pesan lo mismo que la masa atómica del compuesto. La definición oficial utiliza al átomo de carbono como referencia ya que éste pesa exactamente 12 umas y la IUPA definió (en 1971) mol como “la cantidad de átomos de carbono que pesan 12 gramos”.
Gracias a este concepto de “Mol” todos los cálculos físicos y químicos se han simplificado evitando el uso de millones de engorrosos decimales. Por el importante descubrimiento que generó su ley, ese número de moléculas fue llamado Número de Avogadro (NA) pero poder calcular el valor del número sería una ardua tarea!! Mediante medidas físicas se logró determinar el volumen aproximado de una molécula y después el espacio que ocupaba en estado gaseoso, lo que permitió llegar unos 50 años después al deseado número arrojando un valor impresionante: 6.0221415 × 1023.
Esa es la cantidad de partículas que hay en un mol, como por ejemplo en 2 gramos de hidrógeno, imaginad lo pequeñas que son las moléculas de H2!! Este valor tiene más ceros de los que puede parecer a simple vista, veintitrés!!! Realmente es casi casi increíble y precisamente es por esta dificultad para calibrar en su medida este NA por lo que han surgido tantas analogías que lo explican de forma más física. Así llegamos de nuevo a la frasecita de Javinete:
Bueno, todo esto viene a cuento de su última frasecita… Una que tocaba de pleno mi querida química y en especial un concepto algo complicado de entender, los Moles, pero vayamos por partes, lo primero el curioso Nick: “Todo el volumen de la Luna dividido en bolas de 1mm de radio daría el número de Avogadro”…
 Nada más leerlo seguro que os llama la atención el Número de Avogadro (a partir de ahora NA que soy muuu vago….). Pues bien, este número es una de las constantes más impresionantes que existen dentro de las ciencias, es de una magnitud casi inimaginable, más del doble que la velocidad de la luz, y tan difícil de explicar que sirvió para definir un concepto al que no se le puso nombre definitivo hasta el 1971 aunque el químico italiano Amadeo Avogadro ya intuyó su significado allá por el 1811. La famosa ley que él mismo promulgó, La Ley de Avogadro, dice: "Volúmenes iguales de gases diferentes contienen el mismo número de partículas, a la misma presión y temperatura".
Nada más leerlo seguro que os llama la atención el Número de Avogadro (a partir de ahora NA que soy muuu vago….). Pues bien, este número es una de las constantes más impresionantes que existen dentro de las ciencias, es de una magnitud casi inimaginable, más del doble que la velocidad de la luz, y tan difícil de explicar que sirvió para definir un concepto al que no se le puso nombre definitivo hasta el 1971 aunque el químico italiano Amadeo Avogadro ya intuyó su significado allá por el 1811. La famosa ley que él mismo promulgó, La Ley de Avogadro, dice: "Volúmenes iguales de gases diferentes contienen el mismo número de partículas, a la misma presión y temperatura".Esta teoría relacionaba pesos con volúmenes. Se puede entender que un número igual de dos compuestos, ya sean elementos gaseosos (He, Helio que es gaseoso), moléculas (como H2, Hidrógeno gaseoso) o compuestos (como el CO2, dióxido de carbono) en las mismas condiciones de temperatura y presión ocupen el mismo espacio, o sea, el mismo volumen, gracias a que el tamaño real de las partículas es ínfimo si lo comparamos frente a los huecos que las separan. Esto se vio demostrado poco después gracias a reacciones (dos volúmenes de H2 y uno de O2 generan dos volúmenes de H2O) y sirvió como base para crear el concepto de concentración tal y como lo conocemos hoy en día, una cantidad de materia dentro de un espacio.
 Pero para relacionar el número real de partículas que hay en un volumen determinado se decidió arbitrariamente usar la masa como referente, me explico: Una molécula de Hidrógeno (H2) pesa 2 “unidades de masa atómica” (Umas) y una de Oxígeno (O2) pesa 32 umas mientras que una de H2O pesa 17 umas, así se comprobó que 4 gramos de H2 reaccionaban exactamente con 32 gramos de O2 para generar 36 gramos de agua (H2O). Esto hizo decidirse a los científicos a crear un nuevo concepto llamado “Mol” que se puede definir como la cantidad de átomos que pesan lo mismo que la masa atómica del compuesto. La definición oficial utiliza al átomo de carbono como referencia ya que éste pesa exactamente 12 umas y la IUPA definió (en 1971) mol como “la cantidad de átomos de carbono que pesan 12 gramos”.
Pero para relacionar el número real de partículas que hay en un volumen determinado se decidió arbitrariamente usar la masa como referente, me explico: Una molécula de Hidrógeno (H2) pesa 2 “unidades de masa atómica” (Umas) y una de Oxígeno (O2) pesa 32 umas mientras que una de H2O pesa 17 umas, así se comprobó que 4 gramos de H2 reaccionaban exactamente con 32 gramos de O2 para generar 36 gramos de agua (H2O). Esto hizo decidirse a los científicos a crear un nuevo concepto llamado “Mol” que se puede definir como la cantidad de átomos que pesan lo mismo que la masa atómica del compuesto. La definición oficial utiliza al átomo de carbono como referencia ya que éste pesa exactamente 12 umas y la IUPA definió (en 1971) mol como “la cantidad de átomos de carbono que pesan 12 gramos”.Gracias a este concepto de “Mol” todos los cálculos físicos y químicos se han simplificado evitando el uso de millones de engorrosos decimales. Por el importante descubrimiento que generó su ley, ese número de moléculas fue llamado Número de Avogadro (NA) pero poder calcular el valor del número sería una ardua tarea!! Mediante medidas físicas se logró determinar el volumen aproximado de una molécula y después el espacio que ocupaba en estado gaseoso, lo que permitió llegar unos 50 años después al deseado número arrojando un valor impresionante: 6.0221415 × 1023.
Esa es la cantidad de partículas que hay en un mol, como por ejemplo en 2 gramos de hidrógeno, imaginad lo pequeñas que son las moléculas de H2!! Este valor tiene más ceros de los que puede parecer a simple vista, veintitrés!!! Realmente es casi casi increíble y precisamente es por esta dificultad para calibrar en su medida este NA por lo que han surgido tantas analogías que lo explican de forma más física. Así llegamos de nuevo a la frasecita de Javinete:
“Todo el volumen de la Luna dividido en bolas de 1mm de radio daría el número de Avogadro“
Tras leerla me quedé tan impactado que comenzamos una intensa (y algo alocada) conversación sobre ella que es la culpable de este post, pero lo más importante es que según él mismo me comentó, un amigo había tratado de calcular si era verdad la impresionante sentencia descubriendo que existía un error y no correspondía el valor total del volumen de las bolitas con el de la Luna, lo que ya terminó de picarme para hacer los cálculos correspondientes!! Para no asustaros voy a usar la calculadora del Google para que podáis comprobar vosotros mismos los datos!!
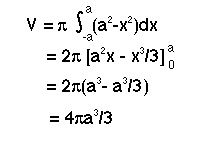 El volumen de una esfera viene dado por la ecuación:
El volumen de una esfera viene dado por la ecuación:4/3 * pi * (radio) elevado al cubo
Así calculé el volumen de una simple bolita (en metros cúbicos para evitar complicaciones en los cambios de unidades) con los datos de radio = 0.001 metros. El resultado fue 4.1887902 × 10-9 que multiplicado por el NA (6.0221415 × 1023) resultó 2.52254873 × 1015, un dato que no concordaba nada con el volumen de la luna: aproximadamente 22 × 1018 metros cúbicos.
Pero decidido a no dejar pasar la oportunidad de refutar una sentencia de ese calibre enseguida pensamos en que ese era el volumen de las bolitas, únicamente de la bolitas, sin contar el espacio que queda libre entre ellas y por eso mismo me puse a investigar los índices de compactación que se dan en los empaquetamientos de esferas. Aquí me han venido de lujo mis apuntes de Química Inorgánica de donde pude rescatar los grados de ocupación de las diferentes estructuras de empaquetamiento (PDF sobre Redes Iónicas y los Huecos según la estructura), los empaquetamientos Hexagonal compacto y el Cúbico Centrado en las Caras tienen un índice de huecos del 26%, por eso el volumen total de las bolitas en este empaquetamiento sería: 3.1784114 × 1015...
Aún muy lejano del volumen real así que probé con el empaquetamiento menos compacto, o sea, el que más huecos tenía, el cúbico simple, que tiene un 48% de huecos y da un resultado de 3.73337212 × 1015… un resultado igual de pésimo… así habíamos refutado la frasecita pero me quedaba la intriga de donde habría surgido la idea de esta frase (que se puede leer hasta en Wikipedia) y de pura casualidad, al comprobar las medidas de la luna me di cuenta de una muy llamativa y aproximada al NA, dependiendo de donde se busque la masa de la luna, en Kilogramos, tiene un valor cercano a 6,3 × 1023… Quizás sea de aquí de donde partió la idea y alguna mala traducción haya generado la frasecita…
 Sea como fuere me ha quedado claro que las analogías son bastante más complicadas de lo que parece, y más aun cuando entran en juego números del calibre del NA, aunque os puedo asegurar que esta no es la única que existe, al ir buscando sobre este tema me he encontrado con miles de ellas y algunas tan originales como las que os dejo aquí a modo de saludo… Disfrutarlas pero, por favor, ni las pongáis en duda!!! Jajajaj!!!
Sea como fuere me ha quedado claro que las analogías son bastante más complicadas de lo que parece, y más aun cuando entran en juego números del calibre del NA, aunque os puedo asegurar que esta no es la única que existe, al ir buscando sobre este tema me he encontrado con miles de ellas y algunas tan originales como las que os dejo aquí a modo de saludo… Disfrutarlas pero, por favor, ni las pongáis en duda!!! Jajajaj!!!Si pudieras viajar con la rapidez de la luz, te tomaría más de 62 000 millones de años recorrer el un mol (un cantidad igual al NA) de kilómetros…
Una pila de papel que tuviese un mol de hojas sería tan alta que llegaría de la Tierra al Sol, más de un millón de veces…
Un mol de libros de Texto cubrirían una superficie como la de Estados Unido hasta una altura de 320 Kilómetros de altura!!
Por las cataratas del Niágara fluye un torrente de 650 millones de litros por minuto, a este ritmo se tardaría 134 mil años en que pasara un mol de gotitas de agua…
El NA es aproximadamente el número de mililitros que contiene el océano pacífico…
Supongamos que el gran dios Zeus, tras observar el Big Bang hace 15 billones de años, estuviera tan aburrido que decidiera contar un mol de átomos y supongamos que en su omnipotencia pudiera contar un millón de átomos por segundo y más aún, supongamos que desde entonces no ha descansado ni para dormir… en ese caso solo habría contado tres cuartas partes del mol, le quedarían aun 4 billones de años de tarea!!
Si esparciéramos un mol de granos de arena sobre España, nos cubriríamos con una capa de casi metro y medio!!
Y para terminar quizás la más interesante de todas… Los Astrónomos consideran que existe un mol de estrellas en el universo… WOWWWWWWW!!!
~ Enlaces:
El número de Avogadro en Wikipedia (NA)
Ley de Avogadro
Comparativas del Número de Avogadro!! (Avogadro’s Numer Analogies)
Más Analogías del NA
Valor de NA según Google
Concepto de Mol
Concepto e Historia del Mol
El volumen de las bolas de 1 mm por el google
Empaquetamiento de Hilbert y el máximo número de besos!!
Sobre la Luna y el Sol
~ PD para Javinete: Muchacho… recuérdame que no volvamos a ponernos tan locos con el tema… menudo par de pirados estamos hechos!! Jajajaja!!!


 I'm in Gryffindor!!
I'm in Gryffindor!!
Hola tu guapiisimo Aprendiz..!!
ResponderEliminarPrimero.. esos contactos del messenger son muy muy interesantes y nos permiten tener horas y horas de conversaciones muy muy interesantes...
Segundo para hacer honesta jeje del numero de Avogadro.. no sabia mucho..solo un poco y eso porque se utiliza en fisica jeje.solos abia que la masa de un atomo en gramos es el cociente entre su peso atomico y el numero de A...!!
lo de la luna woooooooooooooooooooooowwww splashhhhhhhhhhh no sabia...
solo me rio en esta oportunidad de mi ignorancia jejej..entonces ya la afirmacion ni la pongo en duda !!!jjeje..
saludos guapo y un fuerte abrazo..y un besote muakkkkkk..
pd: Gracias por el favor jeje ya pude publicar, pero por motivos ajenos a mi voluntad me toco cambiar de cancion.. esto de le tecnologia hace a veces lo que quiere conmigo jejejej..y bueno coloque una muy muy muy buena que me gusta. espero tu tb la disfrutes..jajaj.
Descubro que también es muy interesante hacer "zaping" por los blogs... jejeje...!!! Menuda lección nos das. Sigue siendo tan curioso.
ResponderEliminarFelicidades por tu blog, en especial por este post.
Seguiré visitándote...
Un mol de abrazos.
Uer tio yo soy aprendiz de todo maestro de nada,me fascinó tu espacio,tengo 48 tacos tronk,pero...............aunque no tuve muchas posilbilidades.....de estudiar siempre pensé si es necesario tanto saber .........o es mejor vivir de una manera mas simple..........y ni siquiera plantar tomates ...es una utopia???'sale mas barato comprarlos en un mercado???????
ResponderEliminarnu se, ya no se na...pero opino que lo mejor es complicarse la vida lo justo, yo reaprendo a vivir, el número, tu número Na ,lo has aplicado alguna vez?
A mi de momento en mi vida no me hizo falta.....lo que me gusta, si me gusta conseguirlo ...como la cancion de: kilometros de cielo...no se quien ni como eres pero hoy te encontre en el ciberespacio....un favor puedes eviarme en mp3 la cancion de Kilómetros de cielo?, aunque soy experto en tecnologias ,,,no me como el tarro sería un detalle por tu parte ,no te puedo valorar tu espacio,pero prometo repasarlo entero......y ya te contaré ...un saludo ........Duende
P.D. refleja la cancion que has puestoen tu espacio, tu personalidad?? si es así creo que perteneces al grupo de gente que yo denomino .........................ESPECIAL,gracias por estar aki. duendelar@hotmail.com.
madre mía, yo que soy de letras te agradezco infinito tu sabiduría pero, lo siento, tardo un rato en asimilarlo.
ResponderEliminarUn beso
Interesante parrafo, tiene mucha info... los mol ya los conocia, cuando me hicieron quimica... pero no sabia tanto sobre el numero de avogadro, todos los dias se aprende algo nuevo...
ResponderEliminarSalu2
Wow gracias creeme que me ha servido de mucho tener esta info mira te dejo mi correo para uqe me agreges jejeje me quedo una duda y te agradeceria que me ayudaras =D
ResponderEliminaran.da.ac @ Hotmail.com
(la dejo con espacios para evitar el spam)
ok te dejo hombre y muchas gracias por la info me ha sevido de mucho :D
hi, good site very much appreciatted
ResponderEliminar